研究内容
Thesis


Thesis
人工多能性幹細胞(induced pluripotent stem cell; iPS細胞)は京都大学の山中伸弥教授らのグループによって2006年に初めて作られた細胞です。
4つの因子(Oct3/4, Sox2, Klf4, c-Myc)を導入することにより、マウスおよびヒトの線維芽細胞からそれぞれの胚性幹細胞(Embryonic stem cell; ES細胞)に類似したiPS細胞を樹立することに成功しました。
iPS細胞はES細胞と同様に生体を構成する種々の細胞に分化することが可能であると考えられており、主に再生医療への応用を期待されて世界中で研究が進められています。
患者自身の細胞から樹立できるので細胞や臓器の移植を行なうにあたって拒絶反応の問題がないこと、受精卵ないしより発生の進んだ胚盤胞を破壊するというES細胞の樹立に伴う倫理的な問題がないことは、iPS細胞を再生医療に用いる大きなメリットです。
一方で、iPS細胞を利用して疾患の研究や新しい治療薬の開発が進展することも期待されています。
iPS細胞の疾患研究への応用は、患者検体を大量に得ることが困難な神経疾患領域などで精力的に行われています。
iPS細胞が未分化性を維持したまま増幅可能であることと凍結保存可能であることを利用して、十分量の疾患特異的なiPS細胞を再分化させることによって患者から直接採取することの出来ない量の疾患細胞を必要なときに必要な分だけ得ることができ、これまでは出来なかった各種の解析が行えるためです。
血液領域でも、疾患の種類によっては患者から大量の検体を得ることが難しいことも多くありましたが、iPS細胞化と再分化のプロセスを経ることで、例えばプロテオーム解析といった網羅的解析をも施行可能な大量の疾患細胞が得られることが期待されます。
私たちの研究室では、臨床医学の研究室で診療の現場と密接に連携している利点を最大限に活かし、血液疾患患者の貴重な細胞を一部預かり、それらからのiPS細胞樹立を目指す取り組みを行なっています。
東京大学医学部附属病院のみならず、近隣の関連病院とも協力し広く研究の対象となる細胞を利用させて頂いています。
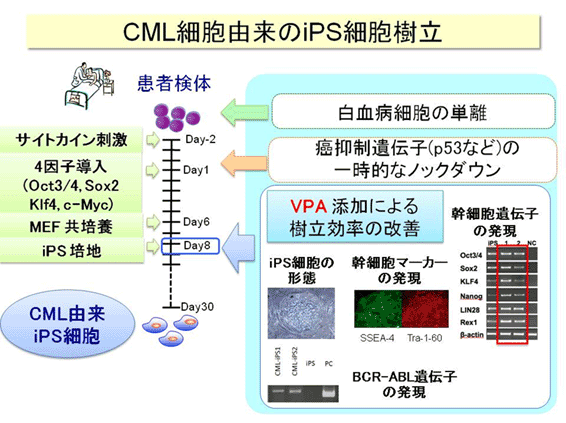
これまでに私たちは、慢性骨髄性白血病(Chronic myeloid leukemia; CML)の患者さんから採取したCML細胞よりiPS細胞を樹立することに成功しました(図参照)。1) さらに、樹立したiPS細胞をiPS-Sac法を用いて造血細胞に再分化させることに成功しました。
CMLの特効薬であるimatinibはCML細胞由来のiPS細胞の増殖は妨げず、一方でそこから再分化させた造血細胞の増殖を抑えることも判りました。
これまでに行なった解析の範囲で正常のiPS細胞と疾患細胞由来のiPS細胞の差異は極めて軽微であると考えていますが、再分化させた造血細胞ではそれぞれの疾患に特徴的な性質を再獲得されるものと考えられます。
この細胞を用いて今後さまざまな網羅的解析を行ないCMLの病態の未知の部分を明らかにしていきたいと考えています。
なお、最近では本態性血小板増多症患者の造血細胞よりiPS細胞を樹立することに成功しました。
このように、血液疾患患者の細胞をリプログラミングの過程を経て大量に増幅することで、血液疾患の未知の病態にせまる新しい研究を可能にしていきたいと考えています。
このような研究から造血器疾患の病態に重要な新しい分子が見つかれば、東京大学GCOE「疾患のケミカルバイオロジー」に参加している点を活かし、標的分子を制御するような化合物の探索を行なうことを考えています。
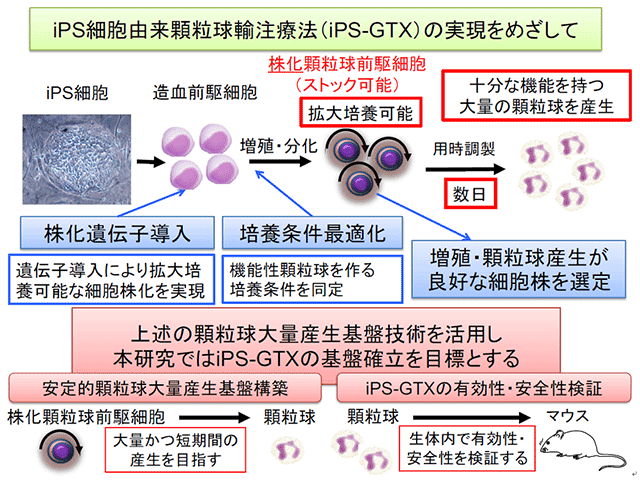
担がん患者は免疫能低下により感染症の発症リスクが高く、がんの治療を目的として行う化学療法は血球減少によりそのリスクをさらに増加させるため、感染症ががん治療を行う上で大きな障害となります。とくに高度に顆粒球が減少した症例の感染症は、現在の補助療法をもってしても対応が困難な場合もあり、新たな対策が必要です。顆粒球輸血療法(granulocyte transfusion therapy;GTX)は50年以上にわたって試みられてきている有力な候補ですが、細胞数の制約やドナーの負担の大きさなどから、広く臨床応用されるには至っていません。
我々はiPS細胞から顆粒球を産生し、それを用いた細胞療法(iPS-GTX)の実現を目標としています。遺伝子導入やサイトカイン刺激による培養条件を検討し、顆粒球を速やかに、かつ臨床効果が期待できる十分な量を連日産生することができるシステム構築を目指しています。
本研究が達成されれば、担がん患者、特に血液悪性腫瘍など、強度の高い化学療法を行うことで根治を目指せる疾患の治療において、治療成績を大きく左右する感染症のコントロールに寄与します。その結果、従来の抗菌剤の治療では困難であった感染症コントロールを可能にし、感染症のリスクから治療の適応にならなかった高齢患者に対しても、根治療法の道が開かれることになります。機能的な顆粒球を大量に産生するための基盤技術を発展させ、臨床応用に必要な安定供給系の構築、生体内での有効性・安全性の確認を行い、早期の臨床応用をめざします。
東京大学医学部附属病院
血液・腫瘍内科
〒113-8655 東京都文京区本郷7-3-1
TEL:(代表)
血液・腫瘍内科では、貧血、白血球減少症、血小板減少症等の造血障害、白血病、悪性リンパ腫等の腫瘍性疾患の他、あらゆる血液疾患の診療を行っています。
【血液・腫瘍内科では教室参加者を募集しています】
東大病院の専門研修プログラムにて、医師免許取得後の二年間の初期研修を修了した後、後期研修医あるいは大学院生として、当院または関連病院にて血液・腫瘍内科医としての専門的な臨床研修を受けることができます。
Copyright© 2026
東京大学医学部附属病院 血液・腫瘍内科 All Right Reserved.
Produced by coanet